quimica 10-2
QUÍMICA
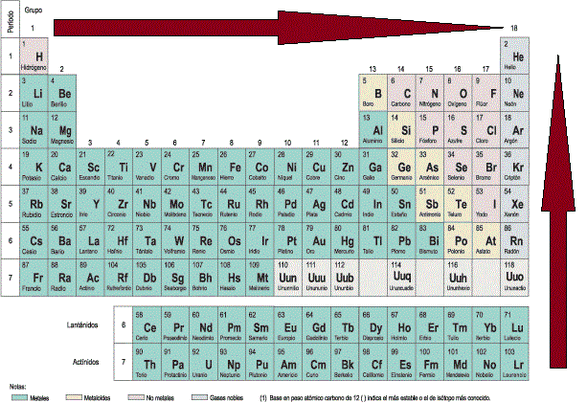
TABLA PERIÓDICA
ESTÁNDAR: Formulo hipótesis con base en el conocimiento cotidiano,teorías y modelos científicos.
COMPETENCIA: uso de
conceptos / explicación de fenómenos
APRENDIZAJE:
DBA: Establece la relación entre la distribución de los electrones en el átomo y el comportamiento químico de los elementos, explicando cómo esta distribución determina la formación de compuestos, dados en ejemplos de elementos de la Tabla Periódica.

A. vivencia
Para avanzar en el tema de tabla periódica vamos a actualizar la información, para ello vamos a leer el artículo que aparece en el siguiente enlace y anexamos estos elementos a nuestra tabla periódica:https://www.nationalgeographic.com.es/ciencia/actualidad/tabla-periodica-renueva_10927
B. fundamentación teórica.
en el siguiente video vamos a hacer un repaso de la organización general de los elementos químicos en la tabla periódica.
En clase trabajamos acerca de la ubicación de los elementos en la tabla periódica de acuerdo a su distribución electrónica y los electrones de valencia, en el siguiente video podremos hacer un repaso y reforzar el tema. en los comentarios podrán hacer sus preguntas.
PROPIEDADES PERIÓDICAS
- Radio atómico: El radio atómico representa la distancia que existe entre el núcleo y la capa de valencia (la más externa). Por medio del radio atómico es posible determinar el tamaño del átomo. En cualquier caso no es una propiedad fácil de medir ya que depende, entre otras cosas, de la especie química en la que se encuentre el elemento en cuestión.
*Disminuye
de izquierda a derecha en los períodos.
*Aumenta
de arriba hacia abajo en los grupos.
Energía de
ionización:
Energía requerida para mover un electrón de un átomo neutro. Aumenta con el
grupo y disminuye con el período.
- Afinidad electrónica: Se llama afinidad electrónica (AE) a la energía asociada al proceso en el que un átomo neutro, aislado y en su estado fundamental, capta un electrón y forma un ión negativo estable. De algún modo viene a indicar la "facilidad con que el átomo puede aceptar al electrón". No sólo es posible remover electrones de los átomos, sino además adicionar electrones a los iones, las moléculas y los átomos.
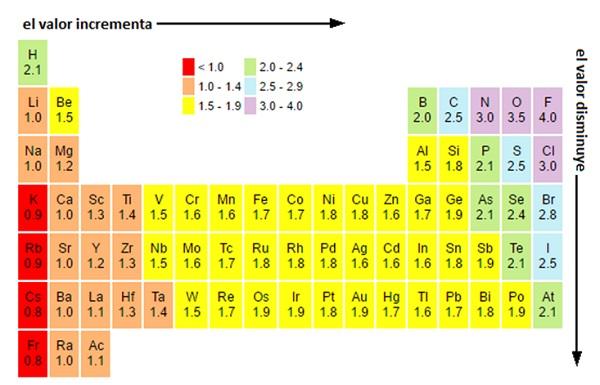
- Electronegatividad de un elemento mide su tendencia a atraer hacia sí electrones, cuando está químicamente combinado con otro átomo. Cuanto mayor sea, mayor será su capacidad para atraerlos.
c. Práctica
Resuelve las siguientes preguntas.
1. ¿Qué
relación encuentras entre la distribución electrónica y la tabla periódica?
2. Escribe los
números atómicos de los siguientes elementos: Ba, Ag, Cl, K, S, P, Ne, Cr, Ca,
U, Mn.
3. Un elemento está
ubicado en el cuarto periodo y en el grupo 7ª (grupo 17). ¿Cuál es su nombre?
¿Cuántos electrones tiene? ¿Cuánto es su peso atómico? y ¿cuánto es número
atómico?
4. Escriba 4 ejemplos
de los elementos representativos, 4 de los transición y 3 de los de transición
interna. A cada uno determine el valor de Z, A, e-, n y su masa atómica
5. Escriba la
configuración electrónica de 4 elementos que hagan parte de los metaloides.
6. Clasifica los
siguientes elementos en metales, no metales y metaloides. Ca, Hg, Fe, Po, C, He, As, Kr, H, Te, Re, Rh, Cl, P, At, Au, Os, Ar, Xe, B, Ar.
METALES
|
NO METALES
|
METALOIDES
|
7. Ordene los
siguientes elementos de mayor a menor según su radio atómico: F, In, Cs, P, Ca,
Br, K, Ar, O, Mn, Mg, Mo, Ir, Sr y Al.
8. Ordene los átomos
siguientes de menor a mayor electronegatividad: Li, Ca, C, Se, Ba, Be, Rb, Na,
P, O, Al, As, Ru, Mo, y K
9.Predice ¿cuál de
los siguientes elementos tiene una mayor afinidad electrónica? Li, F, Na, B
Compara tu respuesta con los valores que aparecen en la tabla periódica.
D. Implementación
Para realizar este momento, direccionarse al siguiente link https://drive.google.com/file/d/1DEYaelnwRhPGCuCkPz87wKuKnh2vfPfC/view?usp=sharing
D. Implementación
Para realizar este momento, direccionarse al siguiente link https://drive.google.com/file/d/1DEYaelnwRhPGCuCkPz87wKuKnh2vfPfC/view?usp=sharing
A CONTINUACIÓN DEJO EL CORREO AL CUAL PUEDEN ESCRIBIRME ENVIANDO SUS TRABAJOS Y SI SURGE ALGUNA DUDA Y ESTAREMOS PONIÉNDONOS DE ACUERDO PARA SESIONES VIRTUALES DONDE ACLAREMOS CUALQUIER INQUIETUD. pilar.ilatareas@gmail.com




hola como estás
ResponderBorrarEste comentario ha sido eliminado por el autor.
Borrar